国产二价HPV疫苗接种须知 国产hpv二价疫苗接种时间
来源: 最后更新:22-10-02 12:38:31
-
双价人乳头瘤病毒疫苗(大肠杆菌)说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名:双价人乳头瘤病毒疫苗(大肠杆菌)商品名:馨可宁®(Cecolin®)
英文名:RecombinantHumanPapillomavirusBivalent(Types16,18)Vaccine(Escherichia
汉语拼音:ShuangjiaRenRutouliuBingduYimiao(Dachangganjun)
【成分和性状】
本品系由大肠杆菌表达的重组人乳头瘤病毒(HumanPapillomavirus,HPV)16和18
型的L1结构蛋白经纯化、重组装成病毒样颗粒(VLP),加入铝佐剂制成。
活性成分:
每剂量(0.5ml)含:
重组人乳头瘤病毒16型L1蛋白40μg
重组人乳头瘤病毒18型L1蛋白20μg
辅料:
氢氧化铝佐剂、氯化钠、二水合磷酸二氢钠、二水合磷酸氢二钠、聚山梨酯80、注射用水。
本品不含防腐剂和抗生素。
性状:
0.5ml注射用混悬液,装于西林瓶中。
本品静置时可分层形成为无色上清液和白色沉淀,摇匀后呈混悬液。
【接种对象】
本品适用于9-45岁女性。
目前尚未证实本品对已感染疫苗所含HPV型别病毒的人群有预防疾病的效果。随着年龄增长暴露于HPV的风险升高,特别是随着性生活开始后暴露于HPV的风险更
为显著,因此建议尽早接种本品。因此在9-45岁年龄范围的低龄人群接种本品的获益会提高。
【作用和用途】
本品适用于预防因高危型人乳头瘤病毒(HPV)16、18型所致下列疾病(详见【临床试验】):
·宫颈癌
·2级、3级宫颈上皮内瘤样病变(CIN2/3)和原位腺癌(AIS)
·1级宫颈上皮内瘤样病变(CIN1)以及HPV16型、18型引起的持续感染。

【规格】
每瓶0.5ml(西林瓶),每1次人用剂量为0.5ml(含rHPV16蛋白40μg,rHPV18蛋白20μg)。
【免疫程序和剂量】
1.本品推荐于0、1和6月分别接种1剂次,共接种3剂,每剂0.5ml。
根据本品临床试验结果,第2剂可在第1剂之后的1~2月内接种,第3剂可在第1剂后的第5~8月内接种。
2.根据本品临床试验结果(详见【临床试验】)并参考2017年WHO《HPV疫苗立场文件》推荐,对9-14岁女性也可以选择采用0、6月分别接种1剂次(间隔不小于5个月)的免疫程序,每剂0.5ml。
3.目前尚未确定本品是否需要加强免疫。
接种说明:
l本品肌内注射,首选接种部位为上臂三角肌。尚无本品皮下接种的临床研究数据;禁止进行血管内或皮内注射。
l本品使用前应充分摇匀,摇匀后为白色均质混悬液。
l每名接种者必须使用单独的无菌注射器和针头。
l自冷藏容器中取出本品后,应尽快接种。
本品西林瓶有裂纹、标签不清或失效者、疫苗外观出现异常者均不得使用。
【不良反应】
按照国际医学科学组织委员会(CIOMS)推荐的发生率表示:十分常见(≥10%),常见(1~10%,含1%),偶见(0.1~1%,含0.1%),罕见(0.01~0.1%,含0.01%),十分罕见(<0.01%),对本品不良反应进行如下描述:
(1)本品临床试验
汇总本品中国境内开展的Ⅱ期、Ⅲ期和桥接研究共3个临床试验,共有4316名18-45
岁和754名9-17岁女性受试者接种本品。观察并记录受试者接种本品后在现场30分钟的即时反应;收集每剂次接种后30天内不良反应/事件发生情况,以及观察期内(66个月)的全部严重不良事件。观察到下列征集性和非征集性不良反应:
全身不良反应
十分常见:发热(≥37.1℃)。
常见:头痛、乏力、咳嗽、肌肉痛、恶心、腹泻、头晕、呕吐。偶见:超敏反应、过敏性皮炎、皮疹、眩晕、瘙痒症。
局部不良反应
十分常见:注射部位疼痛。
常见:注射部位瘙痒、硬结、肿胀、红斑。偶见:注射部位皮疹、不适。

以上大部分不良反应程度为轻至中度。
(2)同类产品境内外临床试验
除上述不良反应外,在同类产品境内外临床试验中还观察到如下全身不良反应:腹痛、关节痛、背痛、肌肉骨骼痛、颈痛、四肢痛、腋窝疼痛、淋巴结病、荨麻疹、玫瑰糠疹、眼睑水肿、上呼吸道感染、呼吸困难、寒战、流感样症状、鼻咽炎、鼻充血、口咽痛、胃肠炎、消化不良、偏头痛、萎靡、嗜睡、晕厥、嗜睡、子宫不规律出血、痛经、咳嗽、多汗。局部不良反应有注射部位淤青、出血、血肿、过敏、丘疹、感觉异常、疤痕。
(3)同类产品上市后监测
除上述安全性信息外,参考境内外同类产品上市后监测,还获得以下安全性数据(此数据是由不确定的人群自愿报告,并不能准确地评估其发生率或确定与使用疫苗有关):
免疫系统:原发性血小板减少性紫癜、支气管痉挛、血管性水肿。
神经系统:晕厥或血管迷走神经反应(有时还伴有强直-阵挛性发作)、急性播散性脑脊髓炎(ADEM)(发生在接种后数天至2周左右,有可能会出现发热、头痛、惊厥、运动障碍性疾病或意识障碍)、格林巴利综合征(表现为诸如从肢体远端开始的弛缓性麻痹、腱反射下降或消失)。
感染和传染:蜂窝组织炎。
其它:受种者可能会出现不局限于注射部位的剧痛(如肌肉痛、关节痛和皮肤痛)、麻木、无力感等并且持续较长时间,但发生机制尚未明确。
【禁忌】
1.对本品中任一活性成分或辅料严重过敏反应者。
2.注射本品后有严重过敏反应者,不应再次接种本品。
【注意事项】
1.疫苗接种不能取代常规宫颈癌筛查,也不能取代预防HPV感染和性传播疾病的其他措施。因此,按照卫生行政相关部门建议常规进行宫颈癌筛查仍然极为重要。
2.接种本品前医疗人员应询问和审阅受种者的病史(尤其是既往接种史和先前是否发生过与疫苗接种有关的不良反应)并进行临床检查,评估接种本品的获益与风险。本品不推荐用于该说明书【接种对象】以外人群。
3.与其他注射用疫苗一样,需准备适当的医疗应急处理措施和监测手段,以保证在接种本品后发生过敏反应者能够及时得到处置。
4.晕厥反应:任何一剂疫苗接种后可能会出现晕厥(昏厥),导致跌倒并受伤,尤其是在青少年及年轻成人中。因此,建议接种本品后按接种规范要求现场留观至少30分钟。
据报道,国外接种同类疫苗后可能会出现与强直-阵挛性发作和其他癫痫样发作有关的晕厥。强直-阵挛性发作有关的晕厥通常为一过性,保持仰卧体位或头低脚高体位,待脑灌注恢复后症状自行消失。部分受种者可能在接种前/后出现心因性反应,需采取措施以避免晕厥造成的伤害。
5.与其他疫苗一样,在受种者患有急性严重发热疾病时应推迟接种本品。若当前或近期有发热症状,是否推迟疫苗接种主要取决于症状的严重性及其病因。仅有低热和轻度的上呼吸道感染并非接种的绝对禁忌。

6.受种者为血小板减少症患者或者任何凝血功能紊乱患者时应谨慎使用本品。
7.与任何其他疫苗一样,接种本品可能无法确保对所有接种者均产生保护作用。
8.本品仅用于预防用途,不适用于治疗已经发生的HPV相关病变,也不能防止病变的进展。
9.本品不能预防所有高危型HPV感染所致病变。尚未证实本品能预防疫苗所含型别以外的其他HPV感染导致的病变以及非HPV引起的疾病。
10.本品尚无在免疫系统受损者(例如使用免疫抑制剂)中使用的数据。与其他疫苗一样,免疫力低下人群接种本品可能无法诱导充分的免疫应答。
11.目前尚未完全确定本品的最长保护期。在本品Ⅲ期临床试验中,对病理高度病变
(CIN2/3和AIS等)的保护效力平均随访66月(中位时间:68.7月),中和抗体持久性研究平均随访66月(中位时间:69.4月),具体结果详见【临床试验】。
【孕妇及哺乳期妇女用药】妊娠:
1.目前尚未进行独立研究系统评估本品对妊娠期妇女的影响。在临床试验期间的极为有限数据(8例)显示妊娠期意外接种本品并未发生妊娠结局和新生儿健康状况的异常,也未发现接种本品后对妊娠率、妊娠结局和新生儿健康状况的不良影响。但这些数据尚不足以判断妊娠妇女接种本品后是否导致发生不良妊娠(包括自然流产)的风险。
2.动物实验中没有发现接种本品对生殖、妊娠、胚胎/胎儿发育、分娩或出生后发育造成直接或间接的不良影响。
3.妊娠期间应避免接种本品。若女性已经或准备妊娠,建议推迟或中断接种程序,妊娠期结束后再进行接种。
哺乳期妇女:
本品尚无相关研究数据。由于许多药物可经母乳分泌,因此,哺乳期妇女应慎用。
【药物相互作用】
1.由于国内尚未进行本品与其他疫苗联合接种的临床试验,目前尚无本品与其他疫苗同时接种的研究数据。
2.接种本品前三个月内避免使用免疫球蛋白或血液制品。
3.尚无临床证据显示使用激素类避孕药是否会影响本品的预防效果。
4.与其他疫苗一样,免疫力低下人群接种本品可能无法诱导充分的免疫应答。与免疫抑制药物同时使用可能不会产生最佳的主动免疫应答。
5.目前尚无临床数据支持本品与其他HPV疫苗互换使用。
6.由于缺乏配伍禁忌研究,本品禁止与其他医药产品混合注射。
【临床试验】
中国境内已完成本品的3项临床试验(表1),在9-45岁女性人群中评价了接种3剂
本品的保护效力、免疫原性(包括9-14岁部分儿科人群接种2剂)、长期保护效果和抗体持久性。
1.保护效力试验结果
在本品HPV-PRO-003保护效力试验中,共入组7372名18-45岁女性,在随访至第42月(中位时间42.5月)时经数据安全与监察委员会(DSMB)独立审核确认后完成期中分析,本品在符合方案集(PPS)人群中对主要临床终点HPV16和18相关的CIN2/3、AIS或宫颈癌的保护效力为100.0%(95%CI:55.7,100.0),预防与HPV-16或HPV-18相关的不同疾病终点的效力见表2。在该研究PPS集中对照组发生1例VaIN1病例(合并发生CIN2),未发现VIN病例。
本品进行期中分析后继续随访至66月(中位时间68.7个月),PPS集新增3例CIN2+
病例,均发生在对照组,结果详见下表。
2.免疫原性结果
(1)18-45岁女性人群的免疫原性结果
在HPV-PRO-003效力试验中,免前对应型别中和抗体阴性且全程接种了3针试验疫苗的受试者中,其首针免后7个月、42个月、66个月的中和抗体结果见表3。
(2)9-17岁女性人群的桥接试验免疫原性结果
在HPV-PRO-006桥接试验中入组了9-14岁接种2针人群、9-17岁接种3针人群、18-26岁接种3针人群,相对于Ⅲ期试验中18-26岁人群,桥接试验中前述3个人群的GMC均达到非劣效标准(GMC比值的95%CI下限大于0.5)。
本品接种9-17岁人群的免疫持久性研究正在进行中。
【贮藏条件】
避光冷藏储存于2℃-8℃。不得冻结,如发生冻结应予以废弃。
【包装】
0.5ml/瓶(西林瓶):本品以0.5ml单剂量包装于西林瓶中,每盒1瓶。
【有效期】
24个月。
【执行标准】
【批准文号】
【生产企业】
企业名称:厦门万泰沧海生物技术有限公司
生产地址:福建省厦门市海沧区山边洪东路52号邮政编码:361027
电话:0592-6536555传真:0592-6536567服务热线:400-001-8508
网址:http://www.innovax.cn
免责声明:本文系转载,版权归原作者所有;旨在传递信息,其原创性以及文中陈述文字和内容未经本站证实。
帮同学化妆最高日入近千 帮朋友化妆帮同学化妆最高日入近千?浙江大二女生冲上热搜,彩妆,妆容,模特,王
2023吉林省紧缺急需职业工种目录政策解读 2024张杰上海演唱会启东直通车专线时间+票价 马龙谢幕,孙颖莎显示统治力,林诗栋紧追王楚钦,国乒新奥运周期竞争已启动 全世界都被吓了一跳(惊吓全世界)热门标签
热门文章
-
帮同学化妆最高日入近千 帮朋友化妆 24-10-07
-
2024杭甬运河宁波段恢复全线通航 杭甬运河属于几级航道 24-10-07
-
2024宁波羽毛球亚锦赛有哪些选手参加(宁波市羽毛球锦标赛) 24-10-07
-
通过对华电车征税提议 通过对华电车征税提议的建议 24-10-07
-
关于网传“男子接亲被加要18万彩礼”情况说明 24-10-07
-
释新闻|登上热搜的哀牢山在哪里,山里都有什么? 24-10-07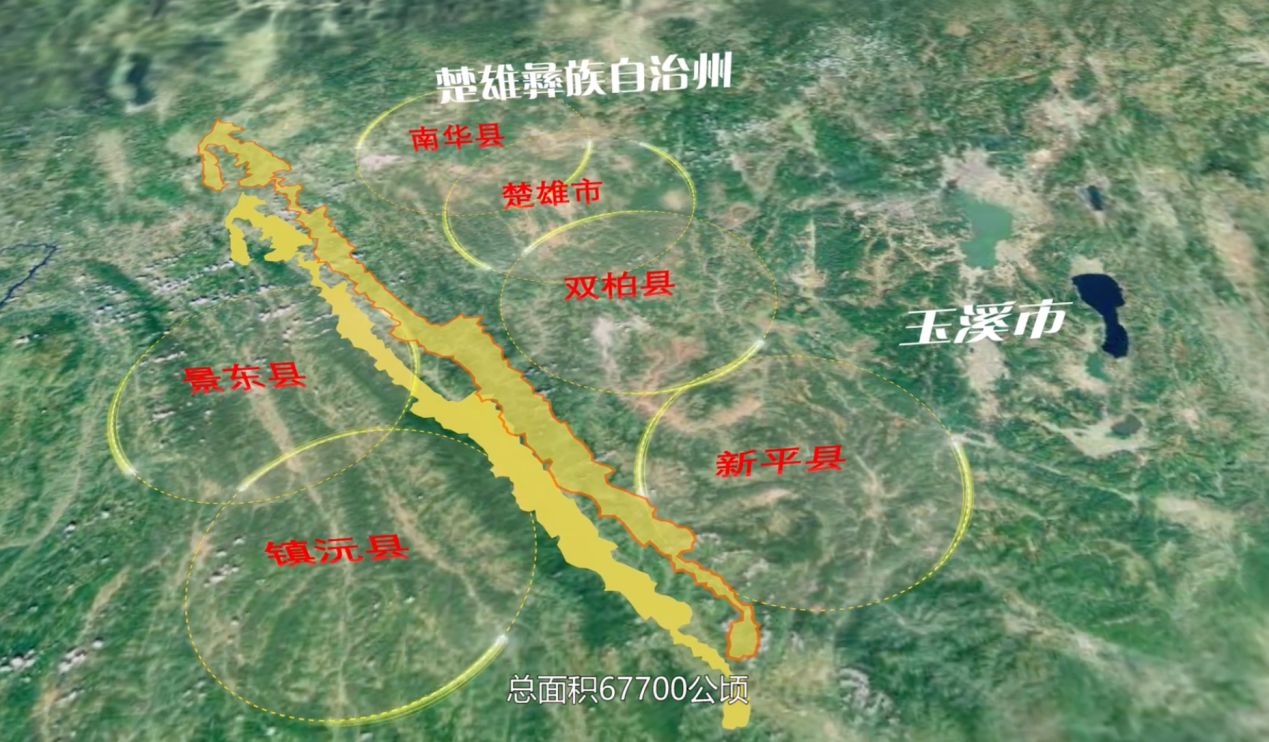
-
2024年江门市公墓清明节祭扫预约方式汇总 24-10-07
-
襄阳市图书馆10月活动(襄阳市图书馆国庆开放时间) 24-10-06
-
2023青岛凤凰音乐节官方有哪些售票平台? 24-10-06
-
民宿老板回应哀牢山爆火:国庆期间房源天天爆满,平时约90元一晚涨到约240元 24-10-06